糖尿病人福音!擺脫胰島素?干細胞療法有望攻克世紀頑癥“糖尿病”
隨著生物、醫學技術的進步,干細胞療法在各個領域大放異彩,既是有望攻克「世紀頑癥」的利器,也有火出圈的美容神器之名,還有「治未病」之美譽。
糖尿病這個古老的疾病,亦有望通過干細胞療法根治。2019 年,美國《時代》周刊將干細胞治療糖尿病納入改變未來十大醫療的 12 大創新發明列表中。
糖尿病治療的「顛覆性技術」
在Ⅰ型糖尿病中,胰島 β 細胞被人體自身的免疫系統所破壞。在 Ⅱ 型糖尿病中,胰島 β 細胞功能被破壞或外周組織胰島素抵抗,現在的糖尿病患者可通過注射胰島素的方式來調節血糖,但這種方式遠比不上自身擁有正常運作的胰島β細胞。
研究發現,糖尿病患者可采用胰島移植,但由于胰島供體的缺乏以及移植排斥反應的存在而限制了其在臨床的應用,現已逐漸轉向干細胞替代療法。
干細胞治療糖尿病的分子機制如下:
1、細胞分化:它在一定條件下可分化成胰島 β 細胞,進而起到調理糖尿病的作用。
2、免疫調節:干細胞的免疫調節作用,可以抑制反應性 T 細胞的增殖,減少 T 淋巴細胞對胰島 β 細胞的損害,提高調節性T細胞的數量,從而誘導機體的免疫耐受。
3、旁分泌作用:通過旁分泌形式分泌多種營養因子或細胞因子,防止胰腺細胞凋亡,促進胰腺細胞的再生和胰腺功能的恢復。
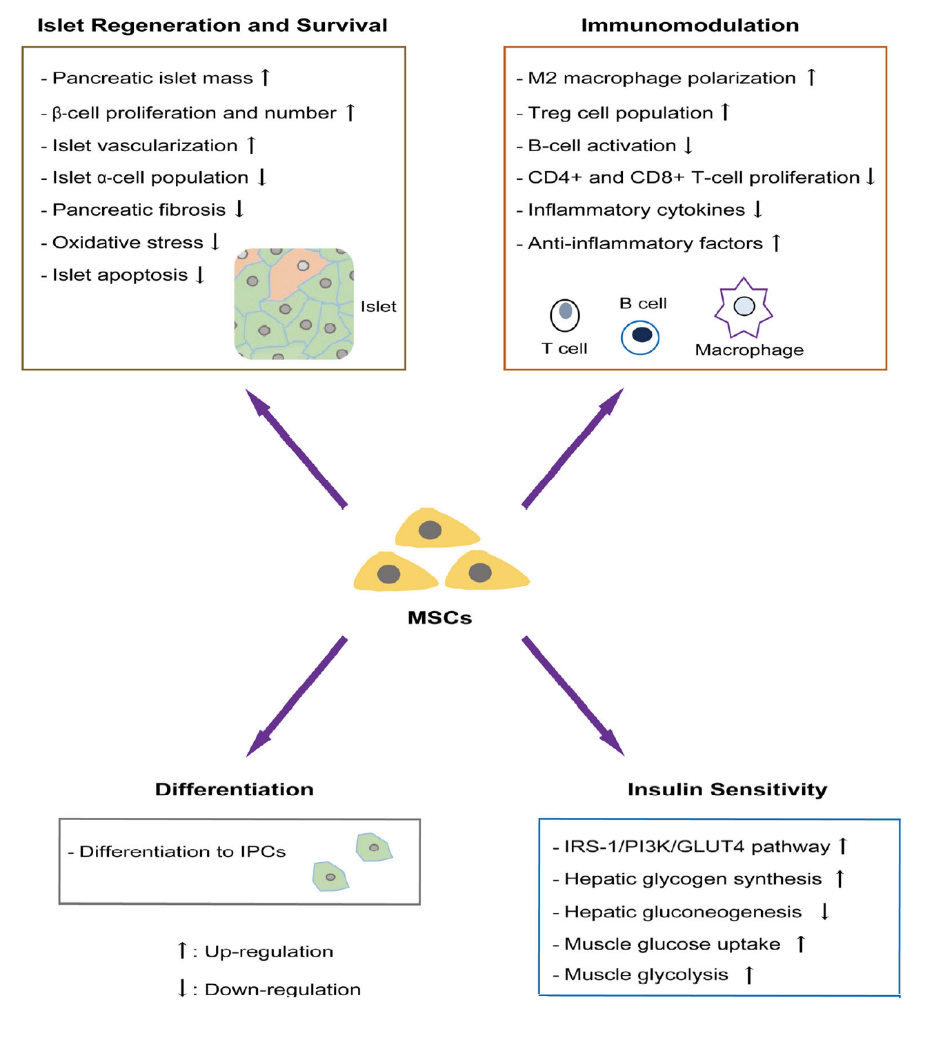
間充質干細胞在糖尿病治療中的作用分子機制
目前針對糖尿病的干細胞應用主要有兩種策略
一種策略是移植胰島素生成細胞。體內胰腺細胞發育的過程和信號通路已經研究得較為清楚,近幾年來研究者們通過在每個階段加入不同的細胞因子(如 EGF、bFGF)和信號調節劑(如骨形態發生蛋白、γ-分泌酶抑制劑)來激活或抑制特定信號通路(如Notch、Wnt),將干細胞定向分化為胰島素分泌細胞(IPCs),再采用免疫隔離裝置包裹,將其移植到糖尿病患者體內,重建糖尿病患者胰島素分泌功能。
體外生成 IPCs 的來源主要包括人胚胎干細胞(hESCs)、人誘導多能干細胞(hiPSCs)、成體干細胞以及成熟組織中可轉分化為 IPCs 的細胞。
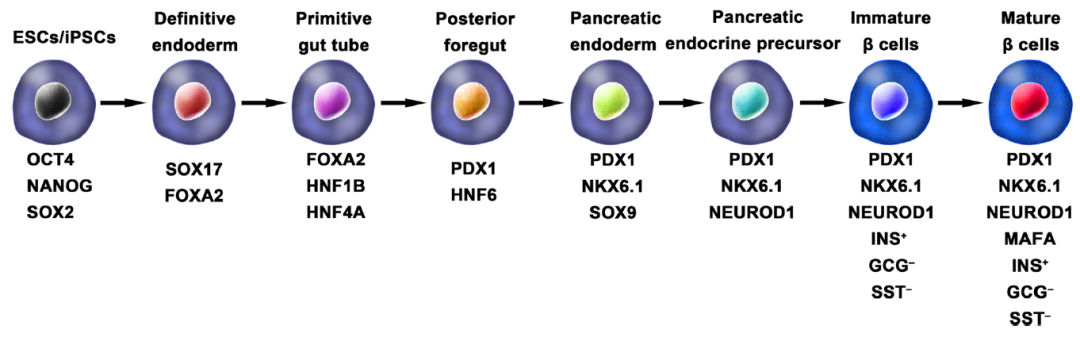
通過 hPSCs 產生胰島β細胞示意圖,圖中包含胰島β細胞所有關鍵發育階段的關鍵分子
另一種策略是通過動脈導管直接移植成體干細胞至人類的胰腺組織中,使干細胞在胰腺微環境的誘導下定向分化為正常的成熟胰島樣細胞并分泌胰島素,從而達到治療糖尿病的目的。
基礎研究與臨床轉化成果裴然
干細胞治療糖尿病的重要研究成果頻出,特別值得一提的是,2022 年 2 月,北京大學鄧宏魁研究組、中國醫學科學院/北京協和醫學院彭小忠研究組和天津市第一中心醫院沈中陽研究組合作在 Nature Medicine 發表的一篇研究,在原有工作基礎上進一步優化和改進了 hPSCs 向胰島細胞的分化制備方案,最終能夠在不同的供體來源的人多能干細胞株上實現穩定、高效的胰島細胞誘導分化,獲得結構和功能與人原代胰島相似的人多能干細胞分化胰島。
同時,進一步將其移植入非人靈長類糖尿病動物模型,系統性地評價了 hPSCs 來源的胰島移植治療糖尿病的安全性和有效性,為進一步規范化實施 hPSCs 來源的胰島移植治療糖尿病臨床研究奠定了堅實的基礎。
干細胞療法的糖尿病臨床試驗在全球范圍內亦開展得如火如荼,截至 2022 年 5 月,據查詢美國國立衛生研究院(NIH)的臨床試驗注冊網站(clinicaltrials.gov),全球關于干細胞治療糖尿病的臨床試驗共有 136 項,其中我國注冊項目 37 項,主要涉及 Ⅰ 型糖尿病、Ⅱ 型糖尿病以及糖尿病血管病變、神經病變、糖尿病足等并發癥的治療。
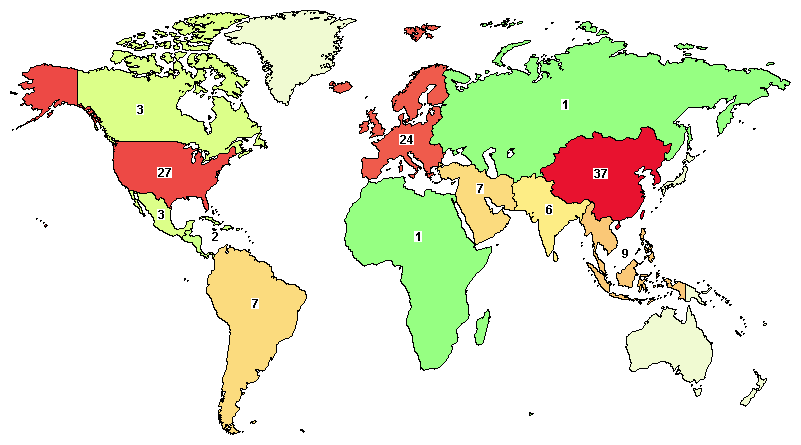
來源:Clinicaltrials.gov
2022 年 5 月 9 日,根據 Diabetes Daily(糖尿病日報)的報道,美國 Vertex 醫藥公司第一個接受多能干細胞的全分化胰島細胞替代療法的 Ⅰ 型糖尿病患者,在接受干細胞 VX-880 移植 270 天后,現在已經完全停止使用胰島素注射。該技術是使用在實驗室中從多能干細胞中培養出來的新胰島細胞移植到患者的門靜脈中,一旦到位,新的胰島細胞就能夠感知血糖濃度并按需分泌胰島素,就像健康的天然胰島細胞一樣工作。
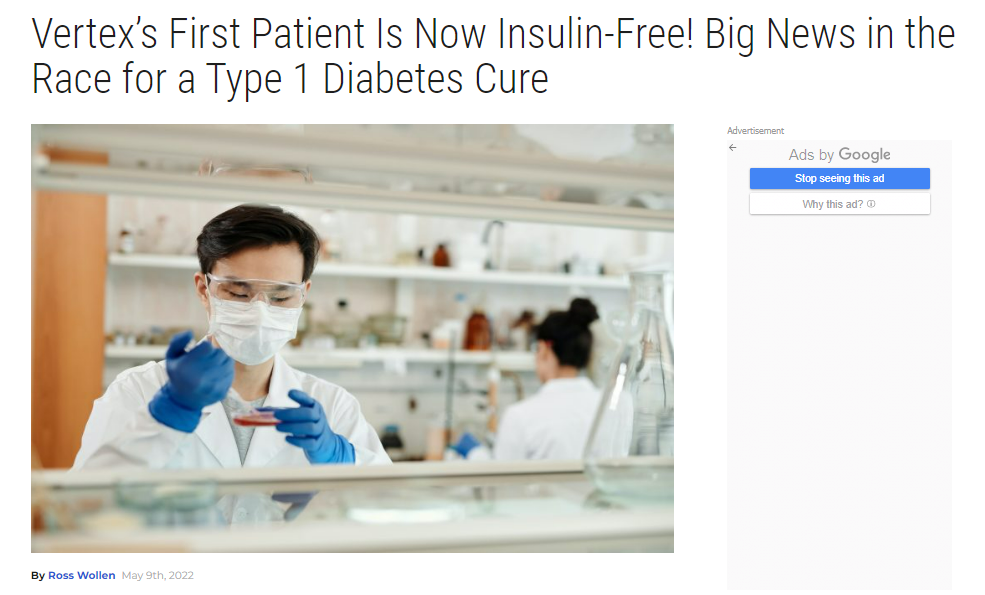
來源:Diabetes Daily
干細胞用于糖尿病治療已獲得令人矚目的進展,未來,還有許多創新策略有望應用于改善治療效果,例如基因修飾、聯合治療、間充質干細胞的外泌體應用、體外生成胰島類器官等。面對機遇與挑戰,Bio-Techne 可為干細胞的分化和培養、分離和鑒定、研究提供全面的解決方案。